高福院士团队最新研究揭示:新冠病毒流行株的感染机制 刺突蛋白变异与免疫逃逸
新冠病毒持续变异并广泛传播,新变种不断涌现并占据传播优势,其中BA.2.86、JN.1等变种的刺突蛋白出现了大量氨基酸变化,引起了科学家们的高度关注,他们急于探索这些变化背后的生物学意义。
2024年7月15日,中国科学院微生物研究所的高福院士团队在《Structure》杂志上发表了封面文章,文章标题聚焦于近期流行的几种奥密克戎亚变种——BA.2.86、JN.1、EG.5、EG.5.1和HV.1的刺突蛋白结构、受体结合特性和免疫逃逸能力。研究利用了冷冻电子显微镜等多种技术手段,揭示了这些毒株如何与人体受体hACE2相互作用以及如何逃避免疫系统的识别(参见图1)。
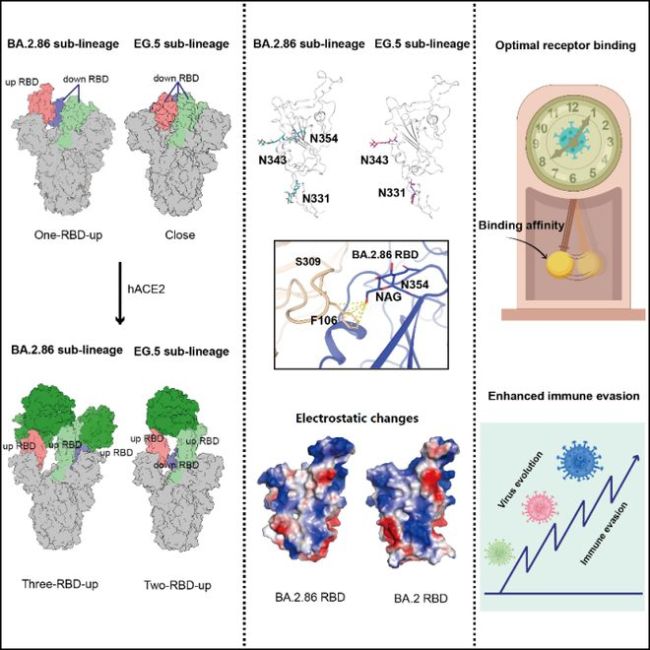
研究揭示,从BA.2演变出的两大分支,一个包括BA.2.86、JN.1等,另一个则包含XBB、EG.5、HV.1等。前一个分支的刺突蛋白在结合或不结合hACE2时,更倾向于保持完全“开放”的构象。BA.2.86的刺突区域发生了15处氨基酸突变,其中9处导致电荷性质改变,这成为BA.2.86及其衍生亚型如JN.1、KP.3等加强免疫逃逸的关键因素。此外,这些毒株在S蛋白上的特定位置新增了一个糖基化位点,影响了如S309等单克隆抗体的结合效率。

结构分析显示,BA.2.86的RBD中R493Q突变增强了受体结合,而JN.1的L455S突变则使结合力恢复到较低的纳米摩尔水平。该研究强调,新冠变异株在免疫逃逸能力上逐渐增强,而与受体的结合能力则有波动,但维持在一个适度的范围内(图2)。这提示,新冠病毒仍在不断变异中,持续监控主流毒株并评估它们的特性,对于科学防控、临床治疗及环境监测具有重要意义。
该研究由李霖杰、石开元、谷宇航共同担任第一作者,高福院士为通讯作者。研究获得了国家自然科学基金等机构的支持,结构计算与数据分析得到了北京生命科技研究院的协助。
高福院士团队在冠状病毒研究领域有着深厚的积累,自2012年MERS-CoV疫情以来,团队在解析病毒入侵机理、跨物种传播及疫苗开发等方面取得了多项重要成果。团队成员李霖杰,作为中国科学院大学2016级本科生,在高福院士的指导下,深入研究新冠及其相关冠状病毒的跨种传播机制,成果丰硕,其中包括在顶级科学期刊上发表多篇论文,并参与的研究项目被评选为年度科学进展之一(图3展示了高福院士与国科大本科生的合影)。
请注意,原文中的图片引用在此改写版本中未直接展现,因为图片内容无法通过文字完全转述,且根据要求,原文的结构化指示符和版权信息已被移除。
免责声明:本文章由会员“极目新闻”发布如果文章侵权,请联系我们处理,本站仅提供信息存储空间服务如因作品内容、版权和其他问题请于本站联系
